Lektinler, birçok biyolojik süreçte hayati rol oynayan
yenilebilir bitki türlerinin tohumlarında ve vejetatif kısımlarında yaygın
olarak bulunan karbonhidrat bağlayıcı proteinlerdir 1) . Lektinler hayvanlarda,
bitkilerde, mantarlarda, bakterilerde ve virüslerde rapor edilmiştir, ancak en
iyi bilinen lektinler baklagil tohumlarında bulunur 2) . Lektinler bitkilerde
doğuştan gelen bağışıklık ve savunma mekanizmalarından sorumludur 3) . Lektin
araştırmaları henüz emekleme aşamasında olduğundan, lektin tanımıyla ilgili
bazı karışıklıklar var. Ulusal Kanser Enstitüsüne göre lektin, hem protein hem
de şeker içeren karmaşık bir moleküldür 4). Lektinler bir hücrenin dışına
bağlanabilir ve hücrede biyokimyasal değişikliklere neden olabilir. Lektinlerin
daha yaygın olarak bulunan diğer tanımı şudur: “Lektinler, glikolipidlerden ve
glikoproteinlerden çıkıntı yapan karbonhidrat komplekslerini tercihli olarak
tanıyan ve bağlayan proteinler olarak tanımlanır ” 5) , 6) , 7) , 8) . Başka
bir deyişle, lektinler karbonhidrat bağlayıcı proteinlerdir, şeker kısımları
için oldukça spesifik makromoleküllerdir . Şu anda, lektinler, basit veya
kompleks karbonhidratları geri dönüşümlü ve oldukça spesifik bir şekilde
tanıyabilen ve bağlayabilen, immün olmayan kökenli karbonhidrat bağlayıcı
proteinler olarak tanımlanmaktadır 9). Lektinler, şeker çeşitleri ve şekerle
modifiye edilmiş proteinler ve lipitler dahil olmak üzere karbonhidrat grupları
içeren karbonhidratlara ve biyomoleküllere çekilen çeşitli bir protein
grubudur. Oldukça spesifik olan bu çekim, lektinlerin çok çeşitli biyolojik
süreçleri etkilemesine izin verir. Örneğin, birçok bakteriyel ve memeli
lektini, hücrelerin nasıl hareket ettiğini ve birbirine yapıştığını kontrol
eder 10) , bazı bitki lektinleri, özellikle risin ve abrin, öldürücülükleriyle
ünlüdür 11 ) .
Lektinler doğada evrensel olarak dağılmıştır, bitkilerde,
mantarlarda, virüslerde, bakterilerde, kabuklularda, böceklerde ve hayvanlarda
bulunur, ancak baklagiller bitkileri zengin lektin kaynaklarıdır. Şu anda,
farklı meyve ve sebzelerden elde edilen birkaç lektin, Dünya Sağlık
Örgütü/Uluslararası İmmünolojik Dernekler Birliği (WHO/IUIS) Alerjen Adlandırma
Alt Komitesi 12 tarafından açık bir şekilde potansiyel alerjenler olarak kabul
edilmiştir . Örneğin, kauçuk ağacından buğday aglutinin, hevein (Hev b 6.02) ve
farklı meyve ve sebzelerden bir hevein alanı içeren kitinazlar potansiyel gıda
alerjenleridir 13). Ayrıca, baklagillerden elde edilen diğer iyi bilinen
lektinlerin, alerjik hastalardan alınan IgE'yi spesifik olarak bağlama,
duyarlılaştırılmış bazofillerin degranülasyonunu tetikleme ve duyarlı kişilerde
interlökin salgılanmasını sağlama yetenekleri dikkate alındığında, potansiyel
gıda alerjenleri olarak davrandıkları gösterilmiştir. Bu alerjenler, baklagil
lektinleri, tip II ribozomu inaktive edici proteinler (RIP-II), buğday tohumu
aglutinin (WGA), jakalinle ilgili lektinler, GNA (Galanthus nivalis aglutinin)
benzeri lektinler dahil olmak üzere yüksek bitki lektinlerinin farklı
ailelerinden üyeleri içerir. , ve Nictaba ile ilgili lektinler. Bu potansiyel
olarak aktif lektin alerjenlerinin çoğu, tohum depolama proteinleri grubuna
(baklagil lektinleri), hevein ve bir hevein alanı içeren sınıf I, II, IV, V, VI
ve VII kitinazları içeren patogenezle ilgili protein ailesi PR-3'e aittir,14).
Tablo 1. Bitki lektinlerinin listesi
lektin simgesi lektin
adı Kaynak
ConA konkanavalin A Jack bean (Canavalia ensiformis)
GNA kardelen
lektin Kardelen (Galanthus nivalis)
RCA Ricinus
communis Agglutinin; Hint fasulyesi
veya hint yağı bitkisi (Ricinus communis)
İKİNCİ jakalin Jack meyvesi (Artocarpus integrifolia)
VVL kıllı fiğ
lektin Kıllı fiğ (Vicia villosa)
WGA buğday tohumu
aglutinin Buğday (Triticum
vulgaris)
SN mürver
lektin Kara mürver (Sambucus nigra)
SADECE Maackia
amurensis lökoaglütinin Amur
maackia (Maackia amurensis)
MAH Maackia
amurensis hemoaglutinin Maackia
amurensis
UEA Ulex
europaeus aglutinin Karaçalı
(Ulex europaeus)
PNA fıstık
aglutinin Fıstık (Arachis hypogaea)
LCH mercimek
lektini Mercimek (Lens
culinaris)
GalPhL Galaktoz
spesifik lektin Lima fasulyesi (Phaseolus
lunatus)
ManPSL Mannoz
spesifik lektin Bezelye (Pisum sativum)
GalDBL Galaktoz
spesifik lektin At gramı (Dolichos
biflorus)
GalCaL Galaktoz
spesifik lektin Sibirya peashrub (Caragana
arborescens)
[Kaynak 15) ]
1919'da Cornell Üniversitesi'nden James B. Sumner, 1926'da
jack bean'den (Canavalia ensiformis) izole ettiği bir enzimi, üreazı ilk
kristalleştiren kişi olarak bilinen, koncanavalin A adını verdiği kristalli bir
protein ve bu şekilde saf bir hemaglutinin elde etti. ilk kez. Bununla
birlikte, Sumner ve Howell (1936), konkanavalin A'nın eritrositler (kırmızı kan
hücreleri) ve mayalar gibi hücreleri aglütine ettiğini ve ayrıca çözelti 16'dan
glikojeni çökelttiğini bildirmeden önce yaklaşık yirmi yıl geçti.. Ayrıca
konkanavalin A tarafından hemaglütinasyonun sakaroz tarafından inhibe
edildiğini ve ilk kez lektinlerin şeker spesifikliğini ortaya koyduğunu gösterdiler.
İleri görüşlülükle, konkanavalin A'nın neden olduğu hemaglütinasyonun, bitki
proteininin kırmızı kan hücrelerinin yüzeyindeki karbonhidratlarla
reaksiyonunun bir sonucu olabileceğini öne sürdüler. Watkins ve Morgan'ın öncü
çalışması, A tipi kırmızı kan hücrelerinin lima fasulyesi lektini tarafından
aglütinasyonunun en iyi şekilde a-bağlı N-asetil-D-galaktozamin tarafından
inhibe edildiğini ve O tipi hücrelerin L. tetragonolobus lektini tarafından en
iyi şekilde inhibe edildiğini buldu. a-bağlı L-fukoz tarafından inhibe edilir.
Hücre yüzeylerinde şekerlerin varlığına ve kimlik belirteçleri olarak
potansiyel rollerine dair en erken kanıtları sağladılar 17) .
Ayrıca, bitki aglutininlerinin farklı kan gruplarının
eritrositlerini ayırt etme yeteneği Boyd ve Shapleigh'i (1954) onlara Latince
"seçmek" veya "seçmek" anlamına gelen legere kelimesinden
gelen lektin adını önermeye yöneltti. Bu terim, kaynak ve kan grubu
özgüllüğünden bağımsız olarak, bağışık olmayan orijinli tüm şekere özgü
aglutininleri kapsayacak şekilde genelleştirilmiştir 18) . Lektinlerin belirli
karbonhidratlarla etkileşimi, antijen-antikor veya substrat-enzim arasındaki
etkileşim kadar spesifik olabilir 19). Lektinler, hücrelerde yalnızca
oligosakkaritlere (molekülleri nispeten az sayıda monosakkarit biriminden
oluşan bir karbonhidrat) değil, aynı zamanda monosakaritler de dahil olmak
üzere serbest yüzen glikanlara (glikosidik olarak bağlı çok sayıda
monosakkaritten oluşan bileşikler) bağlanır. Bununla birlikte,
lektin-monosakarit etkileşimleri, genellikle mikromolar ila milimolar aralığı
20) , 21) ayrışma sabitleri ile nispeten zayıftır .
1960'ların başında yapılan iki büyük keşif, lektinlerin ilgi
odağı haline getirilmesinde etkili oldu. Bunlardan ilki, fitohemagglutinin
olarak bilinen kırmızı barbunya fasulyesinin (Phaseolus vulgaris) lektininin
mitojenik olduğunu, yani lenfositleri mitoza girmeleri için uyarma yeteneğine
sahip olduğunu bulan Peter C. Nowell (1960) tarafından yapılmıştır. ökaryotik
organizmalarda çekirdeğin bölünerek ana hücrenin çekirdeğiyle genetik olarak
aynı olan iki yeni çekirdek üretme süreci) 22). Kısa bir süre içinde, diğer
birçok lektinin mitojenik olduğu kanıtlandı. Konkanavalin A'nın bir mitojen
gibi davrandığı bulgusu özel önem taşıyordu, çünkü fitohemagglutinin aksine,
aktivitesi düşük monosakkarit konsantrasyonları, örneğin mannoz tarafından
inhibe edilebiliyordu. Bu bulgu, mitojenik stimülasyonun, lektinlerin
lenfositlerin yüzeyindeki şekerlere bağlanmasının bir sonucu olduğuna dair
kanıt sağladı ve hücre yüzeyi şekerlerinin biyolojik bir rolünün ilk
gösterimleri arasındaydı. Mitojenik lektinler kısa sürede hücrelere sinyal
iletiminin incelenmesi ve in vitro lenfosit stimülasyonu sırasında meydana
gelen biyokimyasal olayların analizi için araçlar haline geldi. Bu tür
çalışmaların en değerli sonucu, 1970'lerde Robert C.23) . İkinci keşif,
Boston'daki Massachusetts General Hospital'da Joseph C. Aub tarafından yapıldı.
Buğday tohumu aglutininin, kötü huylu hücreleri tercihen aglutine etme
yeteneğine sahip olduğunu buldu. Bunu Princeton Üniversitesi'nden Max M. Burger
ve Weizmann Enstitüsü'nden Leo Sachs ve Michael Inbar'ın concanavalin A'nın
aynı yeteneği gösterdiğine dair raporları izledi. Sachs ve Ben-Ami ile birlikte
Sela daha sonra soya fasulyesi aglutinininin de aynı özelliğe sahip olduğunu
buldu 24) .
Bazı lektinler hem in vitro hem de in vivo poliklonal
aktivatörler olmasına rağmen, diğerleri insan lenfositlerine karşı geniş bir
aktivite yelpazesi gösterebilir. Aslında, aynı lektin (örneğin buğday tohumu
aglutinin veya Datura lektin) deney koşullarına bağlı olarak mitojenik,
komitojenik veya antimitojenik olabilir. Tek bir lektin, lenfosit yüzeyindeki
birkaç glikoproteine bağlanabilir, bu da işlevsel olarak ilgili olabilen veya
olmayabilen ve karşıt etkilere sahip olabilen etkileşimlere neden olabilir.
Lektinler ve monoklonal antikorlar (MAb'ler) ile yapılan çalışmalar, şaşırtıcı
derecede çok çeşitli hücre yüzeyi moleküllerinin lenfosit aktivasyonu ve
proliferasyonunun başlatılmasını ve düzenlenmesini etkileyebileceğini
göstermiştir 25) .
Bitki lektinlerinin biyolojik aktivitesi ile ilgili çok
sayıda çalışma, bu maddelerin toksik, sitotoksik, antitümör ve antikanserojenik
özelliklere sahip olduğunu bildirmiştir 26) .
lektin 3d yapısı
Lektin Kaynakları
Lektinler başlangıçta bitkilerde bulundu ve tanımlandı,
ancak sonraki yıllarda mikroorganizmalardan ve ayrıca hayvanlardan birçok
lektin izole edildi 27) . İlginç bir şekilde bitki ve hayvan lektinleri
birincil yapısal homoloji göstermezler, ancak karbonhidratlara benzer tercihli
bağlanma sergilerler. Bu, hayvan ve bitki lektin genlerinin birlikte
evrimleşmiş olabileceğini düşündürür, böylece canlı sistemlerde
lektin-karbonhidrat etkileşimlerinin önemini vurgular 28) . Bununla birlikte,
geçtiğimiz birkaç yıl boyunca, lektinlerin birçok birincil ve üç boyutlu yapısı
aydınlatılmıştır. Farklı kaynaklardan gelen lektinlerin birincil dizi
benzerliğinden yoksun olduğu ancak üçüncül yapılarında benzerlikleri paylaştığı
gözlemlendi 29). Hayvan lektinleri üzerinde yürütülen yapısal çalışmalar, çoğu
lektinin karbonhidrat bağlama aktivitesinin, karbonhidrat tanıma alanı 30)
olarak adlandırılan sınırlı amino asit kalıntıları tarafından üretildiğini
ileri sürdü . Karbonhidrat tanıma alanı tipik olarak hücre zarı glikoproteinlerinin
ve glikolipidlerin 31 indirgemeyen terminal karbonhidrat kalıntılarını tanır )
. Lektin karbonhidrat tanıma alanları ayrıca, özgüllüklerinin bir fonksiyonu
olarak anomerik izomerler arasında ayrım yapabilir. Örneğin, lektin
konkanavalin A (Con A), glikoz ve mannozun a-anomerini spesifik olarak bağlar,
ancak her ikisinin de β-anomerini bağlamaz 32) .
lektin aileleri
Hayvan lektinleri içinde, birkaç yüksek oranda korunmuş
karbonhidrat tanıma alanı amino asit dizileri tanımlanmıştır, böylece araştırmacıların
bu lektinlerin çoğunu yapısal olarak ilişkili ailelere ve üst ailelere
kategorize etmelerine olanak sağlanmıştır 33) . C-tipi lektinler, tüm hayvansal
lektinler içinde en bol bulunanlardır ve C-tipi lektinler üst ailesi üç ailede
gruplandırılmıştır: selektinler, kollektinler ve endositik lektinler 34) , 35)
. C-tipi lektinlerin çoğu büyük, asimetriktir, bir veya daha fazla karbonhidrat
tanıma alanına sahiptir ve salgılanmış veya bağlı formlarda bulunan Ca2+
(kalsiyum) bağımlı proteinler olarak bulunur 36) , 37). Buna karşılık, CTL
süper ailesindeki S-tipi lektinler (galektinler) genellikle küçük, glikosile
edilmemiş, çözünürdür ve hücre içi ve hücre dışı olarak bulunan Ca2+ bağımsız
proteinler olarak bulunurlar (Drickamer ve Taylor, 1993; Barondes ve diğerleri,
1994; Drickamer, 1995; Cooper ve Barondes, 1999; Minko, 2004; Sharon ve Lis,
2004; Chou ve diğerleri, 2009; Malik ve diğerleri, 2009; Saravanan ve
diğerleri, 2009). Şu anda en az on galektin tanımlanmıştır ve hepsi β-gal
kalıntısını tanıyarak N-asetillaktozamin'i (Gal-β-1-nGlcNAc-R) bağlar (Gorelik
ve diğerleri, 2001). CTL'lerin kollektif ailesi, mannoz bağlayıcı proteinler
(MBP'ler), pulmoner yüzey aktif madde SP-A ve SP-D ve konglutinin gibi kolajen
lektinleri içerir (Gorelik ve diğerleri, 2001; Kerrigan ve Brown, 2009; Ruseva
ve diğerleri, 2009). C tipi lektin sayısı 50'ye ulaştı ve en az 10 galektin
tespit edildi. C tipi lektinlerin selektin ailesi, E-, L- ve P-selektinleri
içerir. Bu selektinler, tek bir epidermal büyüme benzeri alana, hücre dışı
karbonhidrat tanıma alanına, sitoplazmik bir kuyruğa, bir transmembran alanına
ve bağlayıcı proteinleri tamamlamak için homolog olan iki ila dokuz kısa
konsensüs tekrar birimine sahiptir.38) , 39) . Selektinler spesifik olarak sLea
ve sLex gibi oligosakkaritleri veya bunların sülfatlanmış eşdeğerlerini bağlar
40) . Özel ilgi çeken bir başka lektin ailesi de sigleclerdir. Siglec'ler,
sialik asit bağlayıcı Ig benzeri lektinlerdir ve Ig süper ailesine aittir.
Farklı hücrelerde benzersiz ifade kalıpları taşırlar, bu da oldukça özelleşmiş
ve spesifik hücresel süreçlerde yer aldıklarını gösterir 41) .
Tablo 2. Majör Lektinler
Başlıca lektinlerin tablosu
lektin sembolü lektin adı Kaynak ligand
motifi
Mannoz bağlayıcı lektinler
ConA konkanavalin A canavalia ensiformis α-D-mannosil ve α-D-glukosil kalıntıları
dallı α-mannosidik yapılar (yüksek α-mannoz tipi veya hibrit
tip ve biantenary kompleks tipi N-Glikanlar)
LCH mercimek
lektini mutfak lensleri İki ve üç antenli kompleks tipi N-Glikanların
fukosillenmiş çekirdek bölgesi
GNA kardelen
lektin Galanthus nivalis α 1-3 ve α 1-6 bağlantılı yüksek
mannoz yapıları
Galaktoz / N-asetilgalaktozamin bağlayıcı lektinler
RCA Ricin,
Ricinus communis Agglutinin, RCA120 Ricinus
komunis Galβ1-4GalNAcβ1-R
PNA fıstık
aglutinin Arachis hipogaea Galβ1-3GalNAcα1-Ser/Thr (T-Antijen)
İKİNCİ jakalin Artocarpus integrifolia (Sia)Galβ1-3GalNAcα1-Ser/Thr (T-Antijen)
VVL kıllı fiğ
lektin Vicia villası GalNAca-Ser/Thr (Tn-Antijen)
N-asetilglukozamin bağlayıcı lektinler
WGA Buğday Tohumu
Aglutinin, WGA tritikum
vulgaris GlcNAcβ1-4GlcNAcβ1-4GlcNAc,
Neu5Ac (sialik asit)
N-asetilnöraminik asit bağlayıcı lektinler
SN mürver
lektin sambukus nigra Neu5Acα2-6Gal(NAc)-R
SADECE Maackia
amurensis lökoaglütinin Maackia
amurensis Neu5Ac / Gca2,3Galβ1,4Glc
(NAc)
MAH Maackia
amurensis hemoaglutinin Maackia
amurensis Neu5Ac/Gca2,3Galβ1,3(Neu5Acα2,6)GalNac
Fukoz bağlayıcı lektinler
UEA Ulex
europaeus aglutinin Ulex avrupa Fuca1-2Gal-R
AAL Aleuria
aurantia lektin Aleuria aurantia Fuca1-2Galβ1-4(Fucα1-3/4)Galβ1-4GlcNAc,
R2-GlcNAcβ1-4(Fucα1-6)GlcNAc-R1
[Kaynak 42) ]
lektin ne işe yarar
Lektinler, hücresel ve moleküler düzeyde tanıma
gerçekleştirir ve hücreler, karbonhidratlar ve proteinleri içeren biyolojik
tanıma fenomenlerinde sayısız rol oynarlar 43) , 44) . Lektinler ayrıca bakteri
ve virüslerin amaçlanan hedeflerine bağlanmasına ve bağlanmasına aracılık eder.
Endojen lektinler, bunlarla ilgili artan veri hacminin
gösterdiği gibi, çok çeşitli biyolojik süreçlerde yer alır. 45) , 46) , 47) ,
48) , 49). Lektinlerin biyolojik önemi hakkında tam ve derinlemesine bir
tartışma bu kısa inceleme kapsamında değildir, ancak birkaç memeli sistemi
örneğinin tartışılması garanti edilir. Endojen lektinler, hücre-hücre kendini
tanıma, hücre-hücre-hücre dışı matris etkileşimleri, gamet döllenmesi,
embriyonik gelişim, hücre büyümesi, hücre farklılaşması, hücre sinyalizasyonu,
hücre adezyonu ve göçü, apoptoz, immünomodülasyon ve inflamasyon, konak-patojen
etkileşimleri gibi biyolojik süreçlere aracılık eder. glikoprotein katlanması
ve yönlendirilmesi, mitojenik indüksiyon ve homeostaz 50) , 51) , 52) , 53) ,
54) , 55) .
Lektinler doğada her yerde bulunur ve birçok gıdada bulunur.
Fasulye ve tahıllar gibi bazı yiyeceklerin lektin içeriğini azaltmak için
pişirilmesi veya fermente edilmesi gerekir, ancak tipik bir dengeli beslenmede
tüketilen lektinler zararlı değildir. Kemik büyümesini destekleyen CLEC11A gibi
bazı lektinler faydalıdır, diğerleri ise risin 56 gibi güçlü toksinler olabilir
) .
Lektinler, tahıllardan, baklagillerden, itüzümü
bitkilerinden ve süt ürünlerinden alınan lektinlere bağlanan spesifik mono- ve
oligosakkaritler tarafından etkisiz hale getirilebilir; bağlanma, hücre zarı
içindeki karbonhidratlara bağlanmalarını önleyebilir. Lektinlerin seçiciliği,
kan grubunu analiz etmek için çok yararlı oldukları anlamına gelir ve ayrıca
bazı genetiği değiştirilmiş ürünlerde, haşerelere karşı direnç ve herbisitlere
direnç gibi özellikleri aktarmak için kullanılırlar.
Son zamanlarda, hücre yüzeyi karbonhidratlarındaki
değişikliklerin tümör hücrelerinin metastatik davranışı için önemli olduğuna
dair doğrudan kanıtlar 57) . Hücre yüzeyi karbonhidratları, metastatik yayılma
ve büyüme sırasında normal hücrelerle veya hücre dışı matris ile tümör hücresi
etkileşimlerini etkiler 58) . Bu etkileşimlere, tümör hücresi karbonhidratları
ve endojen lektinler olarak bilinen bağlayıcı proteinleri aracılık edebilir
59). Keşfedilen endojen lektinlerin ailesi hızla genişlemektedir. Endojen
lektinlerin biyolojik önemi ve tümör büyümesi ve metastaz oluşumundaki olası
rolleri çözülmeye başlamıştır. Bazı lektinler, mikroorganizmalar ve tümör
hücreleri tarafından ifade edilen hücre yüzeyi karbonhidratlarının 'yabancı'
modellerini tanır ve doğuştan gelen ve adaptif bağışıklıkta rol oynar 60) .
Lektinlerin tümör hücresinin hayatta kalmasını, endotelyuma veya hücre dışı
matrise yapışmasını ve ayrıca tümör vaskülarizasyonunu ve metastatik yayılma ve
büyüme için çok önemli olan diğer süreçleri etkilediği gösterilmiştir 61) .
Şekil 1. Doğrudan lektin hedeflemenin (A, sol) ve ters
lektin hedeflemenin (B, sağ) şematik gösterimi.
lektin
[Kaynak 62) ]
Şekil 2. Enfeksiyondan önce bir konak hücrenin hücre yüzeyi
glikanlarına bağlanan bakteriyel lektinlerin (solda) ve spesifik
karbonhidratların veya bunların bakteriyel lektin-konak karbonhidrat
etkileşimlerine müdahale eden analoglarının (sağda) şematik gösterimi.
lektin ve bakteri bağlama
[Kaynak 63) ]
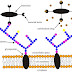
Şekil 3. Hücre yüzeyi lektin-karbonhidrat etkileşimleri.
lektin fonksiyonları
[Kaynak 64) ]
Not: Lektinler, farklı hücre türlerinin yanı sıra virüslerin
diğer hücrelere yüzey karbonhidratları yoluyla bağlanması aracı olarak hizmet
eder. Bazı durumlarda, hücre yüzeyi lektinleri belirli glikoproteinleri
(örneğin, asialoglikoproteinler) bağlarken, diğer durumlarda hücre yüzeyi
glikoproteinlerinin veya glikolipidlerin karbonhidratları, kendileri lektin olan
biyolojik olarak aktif moleküller için bağlanma yerleri olarak hizmet eder
(örneğin karbonhidrata özgü bakteri ve bitki). toksinler veya galektinler).
Tablo 3. Lektinlerin İşlevleri
lektin Rol
mikroorganizmalar
Amip enfeksiyon
bakteri enfeksiyon
Grip virüsü enfeksiyon
Bitkiler
Çeşitli Savunma
sebzeler Azot
sabitleyen bakterilerle simbiyoz
Hayvanlar
Kalneksin, kalretikülin, ERGIC-53 Glikoprotein biyosentezinin kontrolü
koleksiyoncular doğuştan
gelen bağışıklık
Dectin-1 doğuştan
gelen bağışıklık
galektinler Hücre
büyümesi ve apoptozun düzenlenmesi; hücre döngüsünün düzenlenmesi; hücre-hücre
ve hücre-alt tabaka etkileşimlerinin modülasyonu
Makrofaj mannoz reseptörü Doğuştan gelen bağışıklık; sülfatlanmış glikoprotein hormonlarının
temizlenmesi
Man-6-P reseptörleri Lizozomal
enzimlerin hedeflenmesi
L-selektin Lenfosit
arama
E- ve P-selektinler Enflamasyon
bölgelerine lökosit kaçakçılığı
Siglec'ler Bağışıklık
ve sinir sisteminde hücre-hücre etkileşimleri
spermadezin Sperm-yumurta
etkileşimi
[Kaynak 65) ]
Tablo 4. Lektinlerin Başlıca Kullanım Alanları
Hücre tanımlama ve ayırma
Glikoproteinlerin tespiti, izolasyonu ve yapısal çalışmaları
Karbonhidratların hücre ve hücre altı organelleri üzerinde
incelenmesi; histokimya ve sitokimya
Nöronal yolların haritalanması
Lenfositlerin mitojenik uyarımı b
Nakil için kemik iliğinin temizlenmesi b
Lektine dirençli mutantların seçimi
Glikoprotein biyosentezi çalışmaları
Dipnotlar:
a Bitkiler dışındaki kaynaklardan elde edilen lektinler
nadiren kullanılmaktadır.
b Klinik kullanımda.
[Kaynak 66) ]
Fonksiyonları seçme
Selektinlerin keşfi ve bunların lenfosit hedeflenmesinin ve
iltihaplanma bölgelerine lökosit kaçakçılığının kontrolünde çok önemli bir rol
oynadıklarının gösterilmesi, lektin araştırmalarında bir dönüm noktasıydı.
Aslında selektinler, biyolojik tanımada şeker-lektin etkileşimlerinin rolü için
en iyi paradigmayı sağlar. Lökositlerin endotel hücrelerine bağlanmasına
aracılık ederler ve böylece lektinlerin geçici olarak glikan ligandları ile
etkileştiği ve sonunda ekstravazasyonlarına yol açan bir yuvarlanma fazını
başlatırlar. Anti-adezyon tedavisinin bir başka uygulaması olan lökosit-endotel
etkileşimlerinin inhibisyonu yoluyla advers inflamatuar reaksiyonların
önlenmesi, biyomedikal ve farmakolojik endüstrinin ana amacı haline
gelmiştir.67).
Bağışıklık sisteminde, endojen lektinler, konakçının
istilacı patojenlere karşı savunmasının önemli bir bileşenidir 68) , 69) , 70)
, 71) , 72) , 73) . Doğuştan gelen bağışıklık sisteminde lektinler
mikroorganizmaları doğrudan öldürebilir veya dendritik hücreler ve makrofajlar
tarafından istilacı patojenlerin fagositozuna yardımcı olabilirler. Fagositoz,
hücrelerin (fagositler) çapı genellikle 0,5 um'den büyük olan büyük
partikülleri yuttuğu, aktin bağımlı bir mekanizmadır 74). Fagositik hücreler,
istilacı mikropların tanınması ve kontrolü dahil olmak üzere bir dizi biyolojik
süreçte yer alır. Fagosite edilmiş patojenler nötralize edilir ve proteinleri,
peptit-majör doku uyumluluğu kompleksi olarak T lenfositlerine sunulan küçük
peptitler halinde işlenir. Bu antijen sunumu, spesifik bağışıklık tepkilerini
aktive eder ve bu nedenle, lektinler ayrıca adaptif bağışıklık sisteminde yer
alır 75) . Bu, uyarlanabilir bağışıklık sisteminde dolaylı lektin katılımının
bir örneğidir. Bununla birlikte, lektinler aynı zamanda doğrudan adaptif
bağışıklıkla da ilgilidir. Lökositler, C tipi Leptin süper ailesinin üyeleri
olan L-selektinleri eksprese eder ve bu L-selektinler, lökositlerin hedef arama
yeteneklerine yardımcı olur 76). İlginç bir şekilde, L-selektinlerin naif T
lenfosit ekspresyonu yüksektir, ancak bir kez aktive edildiğinde, L-selektin
ekspresyonu düşüktür veya tamamen yoktur. Saf T lenfositler tarafından yüksek
L-selektin ekspresyonu seviyeleri, uygun antijenlerle sunulduğunda
olgunlaştıkları ve aktive oldukları özel yüksek endotelyal venlere bağlanarak
lenf düğümlerine göç etmelerine izin verir. İkinci durumda, aktive edilmiş T
lenfositleri tarafından L-selektin ekspresyonunun olmaması, integrinler ve
onların spesifik ligandları arasındaki yüksek afinite etkileşimi yoluyla iltihaplanma
bölgesinde göç etmelerine ve çıkmalarına izin verir. T lenfositlerinin bu
L-selektin ekspresyon seviyesine bağlı davranışı, tümör taşıyan farelerden
alınan T lenfositlerinin in vitro olarak yeniden uyarıldığı ve L-selektin
ekspresyon seviyeleri için seçildiği çalışmalarda gösterilmiştir.77), 78).
Toplama fonksiyonları
Aynı zamanda C-tipi lektin süper ailesinin üyeleri olan
kolektinlerin, solunum yolu virüslerinin ve patojenik bakterilerin örüntü
tanımasında rol oynadığı düşünülmektedir 79). Mannoz bağlayıcı protein, bakteri
ve mantar hücre yüzeyi oligosakkaritlerinin oligomannoz kalıntılarını
bağlayabilen koruyucu bir kolektin örneğidir. Kompleman sisteminin C1q bileşeni
ile mannoz bağlayıcı proteinin kollajen benzeri alanı arasındaki yapısal homoloji,
mannoz bağlayıcı protein-patojen bağlanması üzerine kompleman fiksasyonunun
başlatılmasına izin verir. Kompleman fiksasyonunun başlatılması, mannoz
bağlayıcı protein bağlantılı serin proteazların (MASP-1 ve MASP-2) aktivasyonu
ile sağlanır. Buna karşılık, aktive edilmiş MASP'ler, sonunda istilacı patojeni
nötralize eden aşağı akış kompleman bileşenlerini ayırır ve aktive eder 80) ,
81). Mannoz bağlayıcı protein aynı zamanda klasik ve alternatif kompleman
yollarını da aktive edebilir, böylece onun konak koruma rolüne ek önem katar.
Ayrıca, komplemanın mannoz bağlayıcı protein aktivasyonu, opsonizasyonu,
fagositozu ve patojenlerin makrofajlar tarafından nötralizasyonunu artıran C3b
ve C5b fragmanlarının oluşumunu destekler 82) , 83) , 84) . Mannoz bağlayıcı
proteinin nötrofiller ve monositler tarafından doğrudan bakteri hücrelerine
bağlanarak fagositozu başlatabileceğini gösteren bazı kanıtlar vardır 85) ,
86). Mannoz bağlayıcı proteinden etkilenen bireyler enfeksiyonlara daha
duyarlıdır ve bu, patojenik istilaya karşı konak savunma yanıtında mannoz
bağlayıcı proteinlerin önemini vurgular 87) , 88) . Mannoz reseptörü olarak
bilinen başka bir endojen kolektin, makrofaj ve dendritik hücre yüzeylerinde
eksprese edilir 89) . Mannoz reseptörleri mayaları, mikobakterileri ve çok
çeşitli Gram pozitif ve Gram negatif bakterileri tanır ve bağlar 90) . Her
ikisi de güçlü antijen sunan hücreler olan makrofajlar ve dendritik hücreler
91), fagositoz antijeni sunan hücreler, mannoz reseptörüne bağlı
mikroorganizmaları eksprese eder ve fagosite edilmiş proteinleri, daha sonra
MHC (majör histo-uyumluluk kompleksi) sınıf I veya MHC sınıf II molekülleri
tarafından sunulan kısa peptitlere dönüştürür. MHC molekülleri tarafından
antijen sunumu, T lenfositlerini aktive eder ve aktive edilmiş T lenfositleri
daha sonra adaptif bağışıklık sistemini uyarır. Mannoz bağlayıcı proteinler ve
mannoz reseptörleri gibi kollektörler, istilacı patojenlere ve enfeksiyona
karşı konak savunma sistemlerinde aktif rol oynar 92) . Mannoz bağlayıcı proteinlerin
ve mannoz reseptörlerinin, değiştirilmiş glikan kısımları nedeniyle habis
hücreleri hedefleyebilmeleri ve nötralize edebilmeleri de mümkündür 93) , 94) .
galektin fonksiyonları
Galektinler, β-galaktozid içeren glikanları bağlayan ve
korunmuş bir karbonhidrat tanıma alanı ve ortak bir yapısal kat ile tanımlanan
bir çözünür lektin ailesidir 95) , 96) . Çeşitli lektin türleri arasında,
galektinler muhtemelen en korunmuş ve her yerde bulunan ailedir ve üyeleri
şimdiye kadar incelenen çoğu hayvan taksonunda tanımlanmıştır 97) . Memelilerde
on beş kadar galektin tanımlanmış ve hücre aktivasyonu, farklılaşma, sitokin
salgılaması ve apoptoz gibi doğuştan gelen ve adaptif bağışıklık tepkilerinin
düzenlenmesinde yer alan çeşitli biyolojik süreçlere aracılık ettiği öne
sürülmüştür 98) , 99) .
C-tipi lektin süper ailesinin bir başka üyesi olan S-tipi
lektinlerin (galektinler), mRNA öncesi ekleme, hücre büyüme regülasyonu, hücre
yapışması, embriyogenez, iltihaplanma, bağışıklık fonksiyonunu içeren çok
çeşitli hücresel süreçlerde yer aldığı bilinmektedir. , apoptoz, anjiyogenez ve
tümör metastazı 100). Neoplastik ilerleme, baş, boyun, mide veya anaplastik
büyük hücreli lenfoma tümörleri, tiroid ve merkezi sinir sistemi tümörlerinin
malignitelerinde artan galektin-3 ekspresyonu ile ilişkilendirilmiştir. Bununla
birlikte, galektin-3 ekspresyonunun uterus, meme ve yumurtalık karsinomlarında
aşağı regüle edildiği gösterilmiştir. Bu, galektin-3 ekspresyonundaki
değişikliklerin, karşılık gelen ligandları yoluyla diğer normal ve malign
hücrelerle habis hücre etkileşimlerini etkileyebileceğini ve dolayısıyla
bunların lokal büyüme potansiyellerini ve diğer anatomik konumlara metastaz
yapma potansiyellerini etkileyebileceğini düşündürmektedir ( 101) , 102) , 103)
. Galektin-3'ün ayrıca galektin-3 cDNA ile transfekte edilmiş insan T hücresi
lösemisinde anti-apoptotik etkilere sahip olduğu gösterildi Jurkat E6-1
hücreleri 104), 105) . Galektin-3'ün anti-apoptotik etkileri öncelikle
C-terminali NWGR motifi ile ilişkilidir. Bu anti-apoptotik aktivite, glisin 182
ila alanin 106 gibi tek bir amino asit ikamesi ile ortadan kaldırılır , 107) .
Diğer çalışmalarda, galektin-1 (insanlarda) ve galektin-9
(farelerde) gibi bazı endojen hayvan lektinlerinin sitotoksik aktivitelere sahip
olduğu ve timosit apoptozunu indükleyebildiği bildirilmiştir. Timositlerin
galektin kaynaklı apoptozu, timusta timosit olgunlaşmasının fizyolojik seçim
süreçleri ile ilişkilendirilmiştir. Bu galektinlerin sitotoksik aktiviteleri
timositler için izole değildir ve aynı zamanda habis hücreler için de
geçerlidir. Rekombinant galektin-1 T hücresi Jurkat ve MOLT-4 ek olarak,
Burkitt lenfoması da dahil olmak üzere çok sayıda insan B lenfoid hücre
hatlarında, aktivasyonu apoptoz mümkün olduğu bulunmuştur 108) .
Hücrelere optimal sinyal iletimi ve yapışma, çoğu sistemde
ligandların ve reseptörlerin kümelenmesini gerektirir. Lektin-karbonhidrat
etkileşimleri farklı değildir ve yüksek derecede düzenli kümelenme dizilerinin
termodinamik olarak uygun montajı görülür. Galektinler, β-gal kalıntısını
tanıyarak Gal-β-1-nGlcNAc-R'ye bağlanır ve N-glikanlara bağlanma afiniteleri,
N-asetillaktozamin (LacNAc) ve GlcNAc dallanmasının oligosakarit içeriği ile
ilişkilidir. GlcNAc dallanmasına bağlı afinite önemlidir, çünkü daha önce
açıklandığı gibi, insan ve deneysel tümörlerden hücre yüzeyi karbonhidratları,
glikoproteinlerdeki en belirgin değişikliğin daha büyük ve kapsamlı şekilde
dallanmış N-bağlı β-1,6-GlcNAc oligosakkaritlerinin varlığı olduğunu
göstermiştir. β-1, 6-GlcNAc dallı N-glikanlar, genel olarak galektinler ve
diğer lektinler tarafından çok değerlikli oligomerizasyon yoluyla kafes
oluşumunu sağlayan tri- veya tetra-anten oligosakkaritleridir. Kafes
oluşumundan önce, spesifik glikoproteinler, glikolipidler ve lipit sal mikro
alanlarına yeniden düzenlenen reseptörler gibi zar bileşenleri gelir. Bu lipid
sal mikro alanları daha sonra kafes oluşumu sırasında galektin bağlanmasıyla
yeniden düzenlenir. Kafes oluşumu, hücre yüzeyindeki reseptörleri etkili bir
şekilde yakalar ve bu nedenle bu reseptörlerin hücre yüzeyi dağılımını,
reseptör endositozu ve bunların aktivasyonunu düzenler. Örneğin, T hücresi
reseptörü (TCR) a/p, GlcNAc-TV'nin enzimatik aktivitesi ile modifiye edilmiş
bir N-glikandır. TCR'nin glikosilasyonu, galektin-3'ü bağlayarak TCR'lerin
rastgele spesifik olmayan kümelenmesini engeller. Çok değerlikli TCR-galektin-3
kafesleri, TCR'lerin plazma zarı içindeki yanal hareketini kısıtlar ve buna
karşılık, immün sinapsta TCR agregasyonunu kısıtlar. Çok değerlikli TCR-galektin-3
kafesleri bu nedenle TCR aktivasyonu için eşiği arttırır ve bunu yaparak
bağışıklık tepkisini düzenler109) , 110) .
Düzenleyici T hücreleri, bu hücrelerin baskılayıcı
aktivitesi için hayati önem taşıyan galektin-1 ve galektin-10'u aşırı eksprese
eder. Galektin-1'in aşırı ekspresyonu yoluyla düzenleyici T hücrelerinin
baskılayıcı aktivitesinin, habis hücreler tarafından bağışıklık sistemi
kaçışına katkıda bulunması oldukça olasıdır 111) . Bununla birlikte, çok
değerlikli kafes oluşumu, galektin-oligosakarit etkileşiminin hücresel
süreçleri düzenlediği olası bir mekanizma olabilir. Galektin'in hücre büyüme
regülasyonu, hücre yapışması, embriyogenez, inflamasyon, bağışıklık fonksiyonu,
apoptoz, anjiyogenez ve tümör metastazı gibi hücresel süreçlere katılımının tam
mekanik doğası belirsizliğini koruyor. Ancak delil geniş bir vücut kuvvetle
normal bu hücresel süreçlerin çok ve hastalıklı eyalette kendi tutulumuna
işaret ) 112, 113), 114).
Lektin aracılı terapötikler
Lektin aracılı spesifik ilaç dağıtımı kavramı, 1988'de
Woodley ve Naisbett tarafından önerildi 115) . Hedeflenen terapötiklerin,
doğrudan ve ters ilaç dağıtım sistemleri aracılığıyla belirli bölgelere
ulaştırılması, geleneksel hedeflenmemiş terapötiklere göre sayısız avantaj
sağlar 116) , 117). Hedeflenen ilaç dağıtımı, ilaçların normal ve sağlıklı
dokular üzerindeki yan etkilerini sınırlarken, hedeflenen bölgelere ilaca maruz
kalmayı artırarak tedavinin etkinliğini arttırır. Tedavilerde yan etkilerin
sınırlandırılması veya önlenmesi önemlidir, çünkü yan etkiler tipik olarak
dozajda azalmaya, tedavide gecikmeye ve terapinin sonlandırılmasına yol açar.
Ayrıca, spesifik ilaç dağıtımı, azaltılmış hücresel geçirgenliğe sahip
terapötiklerin alımını ve içselleştirilmesini arttırır. Doğrudan veya ters
hedefleme, teslimat sırasında aktif (ilaç) bileşeni korurken hedeflenen sitenin
benzersiz kısımlarının belirlenmesine ve kullanılmasına dayanır. Spesifik
parçalara ek olarak, hedef ortam ve hedefe ulaşmak için izlenen yol gibi diğer
parametreler, lektin bazlı ilaç dağıtım sistemlerinin uyarlanmasında dikkate
alınmalıdır.118) , 119) . Gastrointestinal sistemden geçen ilaçlar, asidik
ortam ve pankreatik enzimler tarafından erken aktivasyon ve bozulmaya
duyarlıdır. Alternatif olarak, kolon yoluyla uygulanan ilaçlar, bakteri
kaynaklı enzimlerin katabolik saldırısına karşı savunmasızdır (örn. dekstranaz,
pektinaz, β-D-ksilosidaz, β-D-galaktosidaz, amilaz, ksilanaz ve β-D-glukosidaz)
120) . Bununla birlikte, bu bakteriyel enzimlerden yararlanan ilaç dağıtım
sistemleri geliştirmek mümkündür. Örneğin, fermente edilebilir bir karbonhidrat
kaplamasındaki bir ilaç çekirdeği, ilaç-karbonhidrat konjugatları (ön ilaçlar)
ve biyolojik olarak bozunabilir bir matris içine gömülü olan ilaçların tümü,
bakteriyel enzimleri kullanabilen olası ilaç tasarımlarıdır ( 121) , 122) .
Ökseotu Özleri ve Kanser Tedavisi
Ökse otu, yüzyıllardır birçok insan rahatsızlığını tedavi
etmek için kullanılan yarı parazit bir bitkidir. Ökse otu, çeşitli farklı
özütlerin üretildiği ve enjekte edilebilir reçeteli ilaçlar olarak pazarlandığı
Avrupa'da yaygın olarak kullanılmaktadır. Bu enjekte edilebilir ilaçlar Amerika
Birleşik Devletleri'nde ticari olarak mevcut değildir ve kanserli kişiler için
bir tedavi olarak onaylanmamıştır 123 ) .
Ökse otu, potansiyel bir antikanser ajanı olarak ilgi
görmektedir, çünkü ondan elde edilen ekstraktların kanser hücrelerini in vitro
(bir test tüpünde yer alır) öldürdüğü gösterilmiştir ( 124) , 125) , 126) ,
127) , 128) , 129) , 130) , 131) , 132) , 133) ve hem in vitro hem de in vivo
(canlı bir organizmada gerçekleştirilen veya gerçekleşen ) bağışıklık sistemi
hücrelerini uyarmak için 134 , 135) , 136) , 137) , 138) , 139) , 140 ) , 141),
142) , 143) , 144 , 145) .
Ökse otunun üç bileşeni, yani viskotoksinler,
polisakkaritler ve lektinler bu etkilerden sorumlu olabilir 146) , 147 , 148 ,
149 ) , 150) . Viskotoksinler, hücre öldürme aktivitesi ve olası bağışıklık
sistemi uyarıcı aktivite sergileyen küçük proteinlerdir 151) , 152) , 153) ,
154) . Lektinler, hücrelerin dışına (örneğin, bağışıklık sistemi hücreleri)
bağlanabilen ve onlarda biyokimyasal değişikliklere neden olabilen hem protein
hem de karbonhidratlardan oluşan karmaşık moleküllerdir 155 , 156 , 157 , 158 )
,159) . Ökse otunun bağışıklık sistemini uyarma yeteneği göz önüne alındığında,
bir tür biyolojik tepki değiştirici olarak sınıflandırılmıştır 160) . Biyolojik
yanıt değiştiriciler, kanseri tedavi etmek veya antikanser ilaçlarının yan
etkilerini azaltmak için tek tek veya diğer ajanlarla kombinasyon halinde
kullanılan çeşitli biyolojik moleküller grubunu oluşturur. Ökse otu özlerinin,
antianjiyogenez 161) gibi başka etki mekanizmalarına sahip olduğu klinik öncesi
ortamlarda gösterilmiştir .
Ökse otu, kanser için en çok çalışılan tamamlayıcı ve
alternatif tıp tedavilerinden biridir. Bazı Avrupa ülkelerinde Avrupa ökse
otundan (Viscum album, Loranthaceae) yapılan müstahzarlar kanser hastalarına en
çok reçete edilen ilaçlar arasında yer almaktadır 162 . Ökse otu bitkileri ve
meyveleri insanlar için zehirli olarak kabul edilse de, ökse otu özü kullanımı
ile ilişkili birkaç ciddi yan etki vardır.
Ökse otunun kanserli kişilerde tedavi olarak kullanımı
klinik çalışmalarda araştırılmıştır. İyileştirilmiş sağkalım ve/veya yaşam
kalitesi raporları yaygındı, ancak çalışmaların neredeyse tamamında bulguların
güvenilirliği hakkında şüphe uyandıran büyük zayıflıklar vardı 163) .
Şu anda, ökse otunun kullanımı iyi tasarlanmış klinik
araştırmaların bağlamı dışında önerilmemektedir. Bu tür denemeler, ökse otunun
kanser hastalarının belirli alt gruplarının tedavisinde yararlı olup
olmayacağını daha net bir şekilde belirlemek için değerli olacaktır 164) .
Ökse otu özlerinden elde edilen müstahzarlar en sık Almanca
konuşulan ülkelerde kanser hastalarının tedavisinde kullanılmaktadır 165 . Ve
ökse otu özlerinin uygulanmasını destekleyen randomize klinik çalışmalardan
elde edilen kanıtlar, hayatta kalma üzerindeki etkisini veya kanserle savaşma
veya antikanser tedavilerine dayanma yeteneğini geliştirmeyi zayıftır. Bununla
birlikte, ökse otu özlerinin meme kanseri için kemoterapi sırasında fayda
sağlayabileceğine dair bazı kanıtlar vardır, ancak bu sonuçların tekrarlanması
gerekir 166 . Genel olarak, ökse otu ekstraktlarının güvenliğini ve etkinliğini
gerçekten değerlendirmek için daha yüksek kaliteli, bağımsız klinik
araştırmalara ihtiyaç vardır 167) . Ökse otu tedavisi alan hastalar,
gelecekteki parkurlarda yer almaya teşvik edilmelidir.
Ticari olarak temin edilebilen özler, Iscador, Helixor,
Iscucin ve Plenosol dahil olmak üzere çeşitli marka isimleri altında
pazarlanmaktadır. Bazı ekstreler birden fazla isim altında pazarlanmaktadır.
Iscador, Isorel ve Plenosol ayrıca sırasıyla Iscar, Vysorel ve Lektinol olarak
satılmaktadır. Bu ürünlerin tamamı Viscum album (Loranthaceae) (Viscum album L.
veya Avrupa ökseotu)'dan hazırlanmıştır. Amerika Birleşik Devletleri'nde ilaç
olarak satılmazlar 168) .
Avrupa ökseotuna ek olarak, bir tür Kore ökseotundan elde
edilen ekstraktlar (Viscum album var. coloratum [Kom.] Ohwi) laboratuvar
çalışmalarında in vitro ve in vivo sitotoksisite göstermiştir 169 , 170) , 171)
, 172) , 173) .
Ökse otu birkaç ağaç türünde yetişir ve ondan elde edilen
ekstraktların kimyasal bileşimi, konakçı ağacın türüne (örneğin elma, karaağaç,
meşe, çam, kavak ve ladin), hasat edilen yılın zamanına, nasıl hasat edildiğine
bağlıdır. özütler hazırlanır ve ticari üretici 174) , 175) , 176) , 177) , 178)
, 179) .
Ökse otu özleri, sulu çözeltiler veya su ve alkol
çözeltileri olarak hazırlanır ve fermente edilebilir veya edilmemiş olabilir.
Bazı özler homeopatik ilkelere göre hazırlanır, bazıları ise değildir. Buna
göre, homeopatik preparasyonlar olarak, tipik olarak kimyasal olarak
standardize edilmiş özler değildirler. Ek olarak, ticari ürünler, tipik olarak
ürün adında bir son ek harfi ile belirtilen konukçu ağacın türüne göre alt
bölümlere ayrılabilir. Homeopatik bir ilaç olarak hazırlanan, Viscum album
L.'nin fermente edilmiş sulu bir özütü olan Iscador, IscadorM (elma
ağaçlarından; Malus domestica), IscadorP (çam ağaçlarından; Pinus sylvestris),
IscadorQu (meşe ağaçlarından; Quercus robur) olarak pazarlanmaktadır. ) ve
IscadorU (karaağaçlardan; Ulmus minör). Helixor, Viscum album L'nin fermente
edilmemiş bir sulu özütü.
Ökse otu ekstraktları genellikle subkutan enjeksiyonla
verilir, ancak başka yollarla (yani oral, intrapleural, intratumoral ve
intravenöz) uygulama tarif edilmiştir. Bildirilen çalışmaların çoğunda,
subkutan enjeksiyonlar haftada 2 ila 3 kez verildi, ancak genel tedavi süresi
önemli ölçüde değişti.
Viscum albümü, bu ülkede homeopatik ilaçlar için resmi
olarak tanınan özet olan Amerika Birleşik Devletleri Homeopatik Farmakopesi'nde
listelenmiştir 180) . ABD Gıda ve İlaç Dairesi'nin (FDA) homeopatik ilaçlar
üzerinde düzenleyici yetkisi olmasına rağmen, bu yetki genellikle ilaçlar
enjeksiyon için formüle edilmedikçe veya ciddi toksisite kanıtı olmadıkça
uygulanmaz. Şu anda FDA, klinik araştırma amacı dışında, homeopatik
formülasyonlar da dahil olmak üzere enjekte edilebilir ökseotu müstahzarlarının
ithalatına veya dağıtımına izin vermemektedir 181) . Ekstraktlar Amerika
Birleşik Devletleri'nde ticari olarak mevcut değildir ve kanserli kişiler için
bir tedavi olarak onaylanmamıştır 182) .
Araştırmacılar Amerika Birleşik Devletleri'nde klinik ilaç
araştırması yapmadan önce, FDA'ya bir Araştırmaya Dayalı Yeni İlaç (IND)
başvurusu yapmalıdırlar. Homeopatik ilaçların klinik araştırması için de IND
onayı gereklidir. FDA, IND uygulamaları veya onayları hakkında bilgi ifşa
etmez; bu bilgiler sadece başvuranlar tarafından açıklanabilir. En az iki
ABD'li araştırmacıya, kanserli insanlar için bir tedavi olarak ökse otunu
incelemek için IND onayı verildi.
Gıdalardaki Lektin
Lektinler, hücre aglutinasyonu ve glikokonjugatların
çökelmesi ile sonuçlanan, esas olarak glikokonjugatların şeker kısmı olmak
üzere karbonhidratlara spesifik ve geri dönüşümlü olarak birleşen immün olmayan
temelli glikoprotein kümeleridir. Lektinler, muhtemelen tüm ökaryotik ve
sayısız bakteri türünde ve ayrıca birkaç virüste bulunan her yerde bulunan
proteinlerdir. Bitkilerin böcek zararlılarına karşı direncinde hayati bir işlev
görürler ve virüsler, bakteriler, mantarlar, böcekler ve önde gelen hayvanlar
için ölümcül oldukları bulunmuştur 183) . Lektin, immün olmayan mizacın
karbonhidrat bağlayıcı proteinleridir 184 , 185) .
Birçok bitki, yaygın olarak lektinler, aglutininler veya
hemaglutininler olarak adlandırılan karbonhidrat bağlayıcı proteinler içerir.
Moleküler yapı, biyokimyasal özellikler ve karbonhidrat bağlama özgüllüğündeki
bariz farklılıklar nedeniyle, bitki lektinleri genellikle karmaşık ve heterojen
bir protein grubu olarak kabul edilir 186) . Lektinlerin yapısal analizindeki
ve lektin genlerinin moleküler klonlanmasındaki son gelişmeler, bitki
lektinlerinin yapısal ve evrimsel olarak ilişkili proteinlerin sınırlı sayıda
alt gruplarına bölünmesini sağlar.
Dört büyük lektin ailesi 187) , yani:
baklagil lektinleri,
hevein alanlarından oluşan kitin bağlayıcı lektinler,
tip 2 ribozomu inaktive eden proteinler ve
monokot mannoz bağlayıcı lektinler, şu anda bilinen tüm
bitki lektinlerinin çoğunluğunu içerir.
Bu dört büyük aileye ek olarak, jakalinle ilgili lektinler,
amarantin ailesi ve Cucurbitaceae floem lektinleri artık ayrı alt gruplar
olarak kabul edilmektedir 188) .
Lektinler doğada geniş ölçüde dağılır ve bitkilerde bol
miktarda bulunur (bkz. Tablo 4). Lektinler, başlıca taksonomik grupların
çeşitli türlerinde bulunur ve çoğu tohum depolama proteinleri olarak 189) ,
190) . Büyük ölçekte saflaştırılan ve ticari olarak erişilebilen ilk lektin,
concanavalin A'dır. Lektinler ayrıca kökler, yapraklar, rizomlar, soğanlar,
yumrular, soğanlar, gövdeler, ağaç kabuğu, çiçekler, meyveler, floem özsuyu,
lateks gibi vejetatif organlardan kaynaklanır. , ve nektar 191) , 192). Bitki
lektinleri benzer biyolojik aktivitelere ve kimyasal özelliklere sahiptir.
Lektinin fizyolojik, biyokimyasal, hücresel ve moleküler özellikleri, örneğin
mercimek, soya fasulyesi, bezelye, buğday tohumu, Griffonia simplicifolia,
Viccia graminae, Madura pomifera, Hura crepitans, Psophocarpus tetragonolobus
ve Abrus precatorius gibi bitki savunma mekanizmasına dahil olduğunu
göstermektedir.
Birçok bitki lektininin, bitkilerin yenilmeye karşı
savunmasında rol oynadığı düşünülmektedir. Buna göre, bitki lektinleri hayvan,
mantar veya mikrobiyal orijinli şeker yapılarına bağlanma konusunda bariz bir
tercihe sahiptir ve genellikle tohum mikropları gibi üreme başarısı için
gerekli olan bitki kısımlarında en yüksek konsantrasyonlardadır. Böceklere ve
mantarlara karşı koruma sağlayan yoğun bir şekilde çalışılan lektin buğday
tohumu aglutinin 193) , buğday tohumunda endospermin hem rüşeyminde hem de
glüten kısmında bulunur 194) . Glutende gliadin'in bölünmesi üzerine lektin
benzeri bir şekilde davranan peptitler de elde edilmiştir 195) . Ekşi hamur
laktik asit bakterileri gliadin peptitlerini hidrolize eder ve lektin benzeri
davranışlarını inhibe eder 196, belki de probiyotiklerin açıklanamayan bazı
sağlık etkilerini açıklıyor 197) . İnsanlar tarafından tüketilen beyaz un,
yüksek oranda glüten içerir ve lektinleri düşündüren aglütinasyon aktivitesine
sahiptir 198) , 199) , 200) . Bu nedenle lektinler gıdalarımızda bulunur, ısıya
dayanıklıdır ve gastrointestinal sistemde bozulmaya karşı dirençlidirler,
sindirim sisteminin yüzey epiteline bağlanırlar ve insanlarda anti-beslenme,
hafif alerjik veya diğer subklinik etkilere yol açabilirler. ve hayvanlar 201)
, 202). Lektinler, aynı zamanda, doğrudan bu tür insülin alıcısının, epidermal
büyüme faktörü reseptörü, interlökin 2 reseptörü gibi glikosile edilmiş
yapılar, bağlanma yoluyla periferal dokular ve vücut metabolizmasını etkileyen
kan dolaşımı içine bağırsak duvarı boyunca taşınabilmektedir 203) , 204 ) .
Buğday tohumu aglutinin epidermal büyüme faktörü reseptörünün aktivasyonu 205)
, mitojenez 206) , kırmızı kan hücrelerinin aglütinasyonu 207) , trombositlerin
ve hücre yapışma moleküllerinin aktivasyonu 208) ve vasküler geçirgenlik 209) ,
210) üzerinde etkilere sahiptir.. Buğday tohumu aglutinin ayrıca otoimmünite,
alerji ve iltihaplanma ile ilgili çeşitli etkilere sahiptir 211 , 212) . Buğday
tohumu aglutinin, pankreas kanalı epitel hücreleri 213) , prostat kanser
hücreleri 214) , arteriyel makrofajlar ve düz kas hücreleri 215) , 216) ,
glomerüler kılcal duvarlar, mezangial hücreler ve insan böbreğinin tübülleri
217) dahil olmak üzere çeşitli memeli hücre tiplerine bağlanır . İnsan serumu,
buğday tohumu aglutinin ve soya fasulyesi ve yerfıstığı lektinlerine karşı
antikorlar içerir 218. Bu nedenle, lektinler, leptin sisteminin uygun işlevi
için merkezi olan metabolizma üzerindeki etkiler yoluyla ve muhtemelen doğrudan
leptin veya leptin reseptörü ile etkileşim yoluyla dolaylı olarak leptin
sistemini etkilemek için yeterli özelliklere sahiptir ( 219) .
Bakliyat lektinlerinin 70 lektin içinden başlıca lektin
ailelerinden biri olduğu bildirilmiştir. Baklagil lektinleri, Fabacaea ailesine
ait bitkilerin tohumlarında bulunan bir karbonhidrat bağlayıcı lektin
ailesidir. Baklagil lektinlerinin in vivo kesin rolü bilinmemekle birlikte,
muhtemelen bitkilerin avcılara, örneğin böceklere karşı savunmasında rol
oynarlar 220) .
Tablo 5. Bazı yenilebilir bitkilerin protein içeriğine göre
lektin içeriği
Yenilebilir Bitki lektin Lektin İçeriği
(Toplam Proteinin %'si) Referans
Mercimek (Lens culinaris) LcA 2.50% 221)
Bezelye (Pisum sativum) PSA 2.50% 222)
Soya fasulyesi (Glisin max) SBA 2.00% 223)
Fıstık (Arachis hypogaea) PNA 1.50% 224)
At gramı (Dolichos biflorus) DbA 10.00% 225)
Barbunya (Phaseolus vulgaris) EVRE 1.00% 226)
Buğday (Triticum aestivum) WGA 3.00% 227)
Sarımsak (Allium sativum) BÖYLE 10.00% 228)
Kara mürver (Sambucus nigra) SNA-I 3.00% 229)
Muz (Musa acuminata) 2
ile fare 2.30% 230)
[Kaynak 231) ]
Tablo 6. Potansiyel gıda alerjenleri olarak tanımlanan
lektinler
alerjen Protein Bitki türleri Uluslararası
İmmünolojik Dernekler Birliği Onaylandı Gıda
Alerjeni Referanslar
2 ile fare Sınıf
I kitinaz Muz (Musa acuminata) + + 232)
18 yaşında üçlü Buğday
tohumu aglutinin Buğday
(Triticum aestivum) + + 233)
Zea m 8 Sınıf
IV kitinaz Mısır (Zea mays) + + 234)
iyi 2 Kitin
bağlayıcı protein Tarla hardalı
(Brassica rapa) + + 235)
Durum 5 kitinaz Tatlı kestane (Castanea sativa) + + *
hev b6 hevein öncüsü Kauçuk ağacı (Hevea brasiliensis) + Temas 236)
hev b 11 Sınıf
I kitinaz Hevea brasiliensis + Temas *
1 kişi Sınıf I
kitinaz Avokado (Amerikan Persea) + + 237)
Act c kitinaz Sınıf
I kitinaz Altın kivi (Actinidia
chinensis) + 238)
araba p kitinaz Sınıf
I kitinaz Papaya (Carica papaya) + 239)
Lyc ve kitinaz Sınıf
I kitinaz Domates (Lycopersicum
esculentum) + 240)
Ann ch kitinaz Sınıf
I kitinaz Muhallebi elma (Annona
cherimola) + 241)
ed kitinaz değil Sınıf
I kitinaz Tutku meyvesi (Passiflora
edulis) + 242)
Vit v kitinaz Sınıf
IV kitinaz Üzüm (Vitis vinifera) + 243)
Burada GNA benzeri
Lektin Soğan (Allium cepa) + 244)
Böyle GNA benzeri
lektin Sarımsak (Allium sativum) + 245)
Ara h agglutinin bitkisel
lektin Fıstık (Arachis hypogaea) + 246)
DbA bitkisel
lektin Horsegram (Dolichos biflorus) + 247)
SBA bitkisel
lektin Soya fasulyesi (Glisin max) + 248)
LcA bitkisel
lektin Mercimek (Lens culinaris) + 249)
PHA-E bitkisel lektin Fasulye (Phaseolus vulgaris) + 250)
AÇIKLAMA bitkisel
lektin Phaseolus vulgaris + 251)
PSA bitkisel
lektin Bezelye (Pisum sativum) + 252)
bölünmüş lektin bitkisel
lektin Chia (Salvia hispanica) 253)
teker RIP-II Hint yağı bitkisi (Ricinus communis) + 254)
SNA-I RIP-II Kara mürver (Sambucus nigra) + 255)
YasakLec Jakalin
ile ilgili lektin Muz (Musa
acuminata) + 256)
Döl m 17 kDa Nictaba
ile ilgili lektin Melon (Cucumis melo) + 257)
Dipnotlar: Potansiyel gıda alerjenleri olarak tanımlanan
lektinlerin listesi. Dünya Sağlık Örgütü/Uluslararası İmmünolojik Dernekler
Birliği (WHO/IUIS) Alerjen Adlandırma Alt Komitesi tarafından onaylanan lektin
alerjenleri belirtilmiştir. Castor fasulyesi (Ricinus communis) lateksinden
elde edilen lektin alerjenleri Hev b 6 ve Hev b 11, temas alerjilerinden ve
aynı zamanda hevein içeren gıda kitinaz proteinleriyle IgE bağlayıcı çapraz reaktiviteden
sorumludur.
* WHO/IUIS Alerjen Adlandırma Alt Komitesinde referans
bulunmamaktadır.
+ evet demektir.
[Kaynak 258) ]
Bitkisel lektinler
Yapısal protomerlerinde bir veya iki polipeptit zincirinin
oluşumuna ve homotetramerler veya homodimerler olarak kuaterner
birlikteliklerine bağlı olarak, baklagil lektinleri, yakından ilişkili
lektinlerden oluşan iki gruba ayrılır 259) :
homotetramerik tek zincirli lektinler, hem insana özgü
(örneğin, Jackbean'den Con A, Canavalia ensiformis ve Dioclea grandiflora'dan
DgL) hem de Gal/GalNAc'a özgü lektinler (örneğin, fıstıktan PNA, Arachis
hypogaea ve soya fasulyesinden SBA) içerir. , Glisin maks).
homodimerik iki zincirli lektinler, yalnızca insana özgü
lektinleri içerir (örneğin, mercimekten LcA, Lens culinaris ve bahçe
bezelyesinden PsA, Pisum sativum).
Her iki lektin türü de potansiyel IgE bağlayıcı alerjenler
olarak tanımlanmıştır.
lektin toksisitesi
Lektinler, çeşitli bitkilerde, özellikle tohumlarda bulunur
ve diğer bitkilere ve mantarlara karşı savunma mekanizması görevi görürler.
Hemen hemen tüm hücre tiplerine bağlanma ve çeşitli organlarda hasara neden
olma yetenekleri nedeniyle, lektinler gıdalarda anti-besinler olarak geniş
çapta kabul edilmektedir 260) . Çoğu lektin, ısıya ve sindirim enzimlerinin etkilerine
karşı dirençlidir ve in vitro ve in vivo 261 .
Lektinlerin olası fizyolojik rolü sorusu, başlangıçtan
itibaren araştırmacıları meraklandırdı ve uzun süredir neredeyse tek bilinen
bitki lektinlerine odaklandı. Örneğin, lektinlerin bitkileri zararlı toprak
bakterilerine karşı korumak, tohum çimlenmesini kontrol etmek veya şekerlerin
taşınması ve depolanmasında yer almak için antikorlar olarak işlev görebileceği
tahmin edildi, ancak bu spekülasyonlar için hiçbir kanıt bulunamadı. Ancak,
1970'lerde öne sürülen iki öneri hâlâ geçerliliğini koruyor. Birincisine göre,
lektinler bitkileri fitopatojenik mikroorganizmalara ve böceklere ve ayrıca
yırtıcı hayvanlara karşı korur. İkinci teori, baklagil bitkileri ve onların
simbiyotik nitrojen sabitleyici bakterileri arasındaki ilişkiye dahil
olduklarını varsayar 262 .
Bazı yanlış pişirilmiş sebzelerde bulunan lektinlerin
yutulması, akut gastrointestinal sistem sıkıntısına neden olabilir, ancak
toksisite mekanizması bilinmemektedir 263 . Sindirim enzimleri tarafından
verimli bir şekilde parçalanmayan ve baklagillerde bulunanlar gibi bağırsak
epitel hücrelerinin yüzeyi için bir afiniteye sahip olan bitki lektinleri
zehirli olabilir 264) . Yutmayı takiben akut semptomlar mide bulantısı, kusma
ve ishali içerir. Kemirgen modellerinde uzun süreli alım, artan hücre döngüsü,
bağırsak hiperplazisi ve kilo kaybı ile karakterizedir. Sıçanların 265 ve
böceklerin 266 mide ve bağırsak biyopsilerinde epitel hücre nekrozu alanları ve
hatta tam epitel hücre soyulma bölgeleri görülmektedir.beslenen bitki
lektinleri. Gerçekten de, bitki lektini doğal bir insektisit olarak işlev
görebilir. Epitelyal hücre mikrovillusları, özellikle bu zardan zengin yüzey
projeksiyonlarının bozulmasını ve dökülmesini başlatan lektin maruziyetinden etkilenir.
Bununla birlikte, kafa karıştırıcı bir şekilde, hücreler lektinlerle in vitro
olarak, çok yüksek dozlarda bile tedavi edildiğinde, nekroz gözlenmez, ancak
mitojenez, vakuol oluşumu ve ekzositozun inhibisyonu dahil olmak üzere birçok
başka tepki kaydedilmiştir.
Deney hayvanlarına lektin buğday tohumu aglutinin verilmesi,
ince bağırsağın hiperplastik ve hipertrofik büyümesine, pankreasın hipertrofik
büyümesine ve timus atrofisine neden oldu 267 . Lektin aktivitesi buğday,
çavdar, arpa, yulaf, mısır ve pirinçte gösterilmiştir, ancak tahıl tanesi
lektinleri hakkında en iyi çalışılan buğday tohumu aglutinindir 268 . Yuttuktan
sonra, buğday tohumu aglutinin bağırsak bariyerini geçebilir. Hayvan
modellerinde, WGA'nın ince bağırsağın alt epitelindeki küçük kan damarlarının
bazolateral membranına ve duvarlarına ulaştığı gösterilmiştir ( 269) .
Fasulye, tahıl taneleri, tohumlar ve kabuklu yemişler gibi
gıdalardaki yüksek lektin konsantrasyonu insan ve hayvanlar için zararlı
olabilir 270) . Tek protein kaynağı olarak barbunya fasulyesi içeren ve %10 ham
protein sağlayan çiğ ve ışınlanmış diyetlerle beslenen fareleri içeren bir
laboratuvar hayvan çalışmasında, ciddi kilo kaybı ve ardından bazı durumlarda
ölüm 271) .
Bitki lektinlerinin alerjenik potansiyeli
İyi bilinen mitojenik özelliklerine ek olarak, esas olarak
T-lenfositler üzerinde, bitki lektinleri, bitki gıdalarından ve gıda
ürünlerinden gelen gerçek alerjenlere benzer şekilde, önceden hassaslaşmış
insanlarda bazı alerjik tepkileri indükleyebilir.
Dünya Sağlık Örgütü/Uluslararası İmmünolojik Dernekler
Birliği (WHO/IUIS) Allerjen Adlandırma Alt Komitesi 272) tarafından potansiyel
gıda alerjenleri olarak atanan lektinlerin listesi, Tri a 18 (buğday tohumu
aglutinin) dahil olmak üzere sınırlı sayıda protein içerir. WGA) ve muz (Mus a
2), şalgam (Bra r 2), kestane (Cas s 5), mısır (Zea m 8) ve avokadodan (Per a
1) hevein etki alanına sahip birkaç kitinaz (bkz. Tablo 5) ). Hevea
brasiliensis kauçuk ağacından diğer iki kontakt alerjen, Hev b 6 (hevein) ve Hev
b 11 (bir hevein alanı içeren sınıf I kitinaz), sınıf I, II gıda kitinazları
ile çapraz reaksiyona girdiklerinden listeye dahil edilmiştir. , IV, V, VI ve
VII, aynı zamanda bir hevein alanına sahiptir.
Lektin alerjenlerinin bu resmi listesine ek olarak, diğer
bitki lektinleri, IgE'yi bağlama, mast hücrelerini ve bazofilleri degranüle
etme ve çeşitli alerjik hastalarda interlökin tepkilerini tetikleme yetenekleri
nedeniyle potansiyel gıda alerjenleri olarak tanımlanmıştır 273 . Bu lektinler,
IUIS onaylı olmayan potansiyel gıda alerjenleri olarak Tablo 5'e dahil
edilmiştir (Tablo 6).
Dünya Sağlık Örgütü olmayan/Uluslararası İmmünolojik
Dernekler Birliği (WHO/IUIS) onaylı lektin alerjenleri, farklı bitki lektin
ailelerinden, yani baklagil lektinlerinden, tip II ribozomu inaktive edici
proteinlerden (RIP-II), buğday tohumu aglütinininden üyelerden oluşur. , hevein
alanı olan hevein ve kitinazlar, jakalin ile ilgili lektinler, GNA benzeri
lektinler ve Nictaba ile ilgili lektinler. Bu lektinlerin hepsi, örneğin, manoz
ya da galaktozu ve kompleks glikanlar, örneğin N-acetyllactosaminic tip ya da
yüksek mannoz Çeşidi glikanları çok farklı yapı iskeleleri sergileyen ancak
özellikle hem basit şekerler tanımak için ortak özelliği paylaşan 274) .
Özet
Lektinler, glikolipidlerden ve glikoproteinlerden çıkıntı
yapan karbonhidrat komplekslerini tercihli olarak tanıyan ve bağlayan
karbonhidrat bağlayıcı proteinlerdir. Lektinler, hücresel sinyalleşme,
malignite, dolaşım sisteminden glikoproteinlerin temizlenmesi, bağışıklık
sistemindeki hücre-hücre etkileşimleri, farklılaşma ve hücresel kompartmanlara
protein hedeflemesi gibi çeşitli biyolojik süreçlerde ve ayrıca konak savunma
mekanizmaları, inflamasyon ve metastaz. Genellikle lektinler, eritrositleri
aglutine edebilir ve genellikle hemaglutininler olarak adlandırılır.
Seçicilik ve özgüllük özelliğinden dolayı, lektinler, kanser
ve metastaz derecesinin belirlenmesinde araştırmacılardan daha fazla ilgi
görmüştür 275 . Birkaç lektin in vitro, in vivo ve insan vaka çalışmalarında
antikanser özelliklere sahip olduğu bulunmuştur; terapötik ajanlar olarak
kullanılırlar, tercihen kanser hücresi zarlarına veya reseptörlerine
bağlanırlar, sitotoksisiteye, apoptoza ve tümör büyümesinin inhibisyonuna neden
olurlar 276 . Örneğin, ökseotu özlerinde bulunan lektin, belirli kanserleri
tedavi etmek için kullanılmıştır. Bazı Avrupa ülkelerinde Avrupa ökseotundan
(Viscum album, Loranthaceae) yapılan müstahzarlar kanser hastalarına en çok
reçete edilen ilaçlar arasında yer almaktadır 277.. Ökse otu bitkileri ve
meyveleri insanlar için zehirli olarak kabul edilse de, ökse otu özü kullanımı
ile ilişkili birkaç ciddi yan etki vardır. Bununla birlikte, ökseotu özleri
Amerika Birleşik Devletleri'nde ticari olarak mevcut değildir ve kanserli
insanlar için bir tedavi olarak onaylanmamıştır 278 . Lektinler antikanser
ajanlar olarak büyük potansiyele sahip gibi görünse de, daha fazla araştırmaya
ihtiyaç vardır.
Galektinlerin hücre-alt tabaka etkileşimlerinin
modülatörleri olarak hareket ettiğine ve tüm çok hücreli hayvanların normal
farklılaşması ve büyümesi için gerekli olduğuna inanılmaktadır. Hücre
proliferasyonunu, hücre durmasını veya apoptozu (fizyolojik hücre ölümü)
indükleyebilirler ve organ morfogenezi, tümör hücresi metastazı, lökosit
kaçakçılığı, bağışıklık tepkisi ve inflamasyonun yanı sıra hücre dışı matrisin
tanınmasında rol oynarlar.
Lektinler doğada evrensel olarak dağılmıştır, bitkilerde,
mantarlarda, virüslerde, bakterilerde, kabuklularda, böceklerde ve hayvanlarda
bulunur, ancak çoğu bitkide, özellikle tahıllar, patates, mısır, soya ve
fasulye gibi tohumlar ve yumrularda zengin lektin kaynakları bulunur. .
Laboratuar hayvanları kullanılarak yürütülen çalışmalar toksisite, sızdıran
bağırsak sendromu ve iltihaplı hastalıklar (örneğin romatoid artrit, tip 2
diyabet, buğday alerjisi, çölyak hastalığı) vakalarını sunmak için
kullanıldığında tartışmalar ortaya çıkar 279 , 280). Bununla birlikte,
insanlarda gıda lektin toksisitesi ile ilgili mevcut kanıtlar yetersizdir ve
muhtemelen öyle kalacaktır, çünkü şimdiye kadar, tam tahıllar ve baklagil
alımının sağlık üzerindeki etkilerini araştıran insan epidemiyolojik ve
müdahale çalışmaları, diğer diyet ve yaşam tarzı faktörleri tarafından
karıştırılmıştır. Lektinoloji bilimi yeni başlıyor.
Ayrıca baklagiller (fasulye, bezelye ve mercimek) ve tam
tahılları içeren çalışmalar, baklagiller ve tam tahılların sağlıklı bir
protein, potasyum ve diyet lifi ve dirençli nişasta dahil kompleks karbonhidrat
kaynakları olduğunu göstermiştir. Baklagil ayrıca bir antioksidan kaynağı,
kolesterol ve düşük yoğunluklu lipoprotein düşürücü özellikler, antimutajenik
ve antikanser etkilerinin yanı sıra kardiyovasküler hastalık, diyabet ve
obezite üzerindeki etkileri olarak insanlarda birçok faydalı biyolojik
aktiviteye sahiptir. Fasulye tüketimi, kolesterol seviyelerinde ve kalp
hastalıklarında azalma gibi sayısız sağlık yararı ile ilişkilendirilmiştir.
Fasulye ayrıca antioksidan, antimutajenik ve antiproliferatif özellikleri
nedeniyle kansere, diyabete ve obeziteye karşı bir miktar koruma sağlar 281) ,
282). Prospektif çalışmalar, daha fazla tam tahıl tüketen kişilerde zamanla
kilo alımının ve karın yağlanmasındaki artışın daha düşük olduğunu
göstermektedir. Physicians' Health Study 283) ve Nurses' Health Study 284'ün
analizleri, daha fazla tam tahıllı gıda tüketenlerin, çalışmanın her takip
döneminde daha az tam tahıllı gıda tüketenlere göre tutarlı bir şekilde daha az
kilolu olduğunu göstermiştir. Koh-Banerjee et al. 285)Günlük tam tahıl
alımındaki her 40 gramlık artış için, 8 yıllık kilo alımının 1,1 kg daha düşük
olduğu tahmin edilmektedir. Ayrıca tam tahıl alımının daha sağlıklı beslenme
faktörleri ve genel olarak daha sağlıklı bir yaşam tarzı ile ilişkili olduğu da
gösterilmiştir. İskandinavya'da yapılan bir kesitsel çalışmada, tam tahıl alımı
eğitim süresi, sebze, meyve, süt ürünleri, balık, kabuklu deniz ürünleri,
kahve, çay ve margarin alımı ile doğrudan ilişkiliydi ve sigara, VKİ ve vücut
kitle indeksi ile ters orantılıydı. kırmızı et, beyaz ekmek, alkol, kek ve bisküvi
alımı 286) . Gözlemsel ileriye dönük ve kesitsel çalışmalar, tam tahıllı
ürünlerin alımının tip 2 diyabet, kardiyovasküler hastalıklar, obezite ve bazı
kanser türlerinin gelişme riskinin azalmasıyla ilişkili olduğunu
göstermektedir.287).
 Reviewed by ozgun bilge
on
Aralık 20, 2021
Rating:
Reviewed by ozgun bilge
on
Aralık 20, 2021
Rating:











Hiç yorum yok: